P2O5+2Ca(OH)2=2CaHPO4+H2O m(P2O5)= 7.1 г m(Ca(OH)2)= 3.7 г. найти массу CaHPO4
Ответы:
11-12-2018 12:44
М(СаНРО4)=136 г/мольn(Ca(OH)2)=0,05 мольМ(Са(ОН)2)=74 г/мольМ(Р2О5)=142 г/мольn(Р2О5)=0,05 мольn(СаНРО4)=n(Са(ОН)2)=n(Р2О5)=0,05 мольm(СаНРО4)=6,8 граммОтвет:6,8 г.
Также наши пользователи интересуются:
Сколько процентов составляет 56 от 280?Какие причины влияющие на соленость воды в ок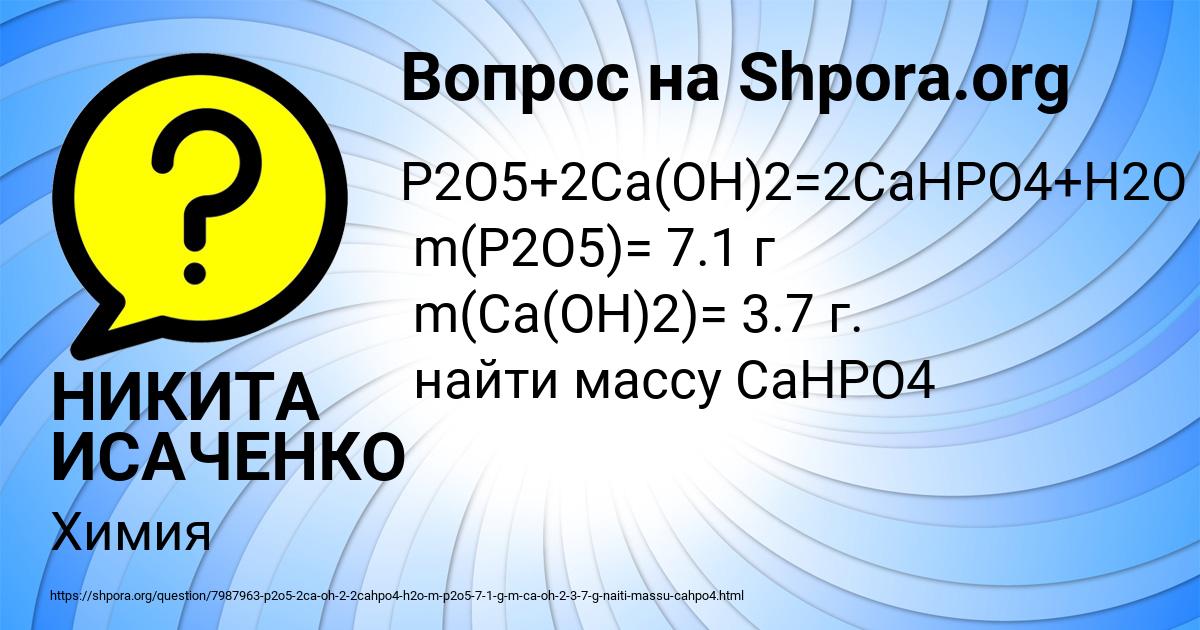
⭐⭐⭐⭐⭐ Лучший ответ на вопрос «P2O5+2Ca(OH)2=2CaHPO4+H2O m(P2O5)= 7.1 г m(Ca(OH)2)= 3.7 г. найти массу CaHPO4» от пользователя НИКИТА ИСАЧЕНКО в разделе Химия. Задавайте вопросы и делитесь своими знаниями.
Открой этот вопрос на телефоне - включи камеру и наведи на QR-код!
